HER2是由HER2-neu基因编码的癌蛋白,是表皮生长因子受体 (EGFR) 家族中的一员,HER2没有已知的配体,通过与其他EGFR蛋白形成同源或异源二聚体而被激活,从而触发磷脂酰肌醇三磷酸激酶 (PI3K) 信号通路,控制细胞生长、分化和迁移。相比其他乳腺癌亚型,HER2阳性肿瘤的预后更差。尽管抗HER2靶向治疗的发展显著改善了HER2阳性乳腺癌患者的预后,但是很多患者仍会产生针对抗HER2靶向治疗的新发或获得性耐药,从而导致疾病的复发或进展。ADC Academy邀请华中科技大学同济医学院附属协和医院赵艳霞教授梳理和解读发表于Cancers杂志的一篇有关乳腺癌抗HER2靶向治疗耐药机制的综述,不仅探讨了与HER2结合受损、受体抑制不完全、其他受体信号增强、与雌激素受体交互串扰和PIK3CA通路激活等耐药机制。还阐述了肿瘤免疫微环境和HER2异质性的作用,以及对新型ADC耐药的独特机制。为更好地理解抗HER2靶向治疗耐药机制以及探索克服它们的潜在策略提供了思路。乳腺癌抗HER2靶向治疗耐药机制有哪些,有哪些克服策略?
抗HER2靶向治疗的作用机制
美国食品药品监督管理局 (FDA) 和/或欧洲药品管理局 (EMA) 批准了多种抗HER2靶向药物,包括单克隆抗体 (mAB)、酪氨酸激酶抑制剂 (TKI) 和抗体药物偶联物 (ADC)。

图1. 抗HER2靶向治疗的作用机制。图例:(A) 曲妥珠单抗和帕妥珠单抗的作用机制;(B)Margetuximab的作用机制;(C) 酪氨酸激酶抑制剂的作用机制;(D) 具有可裂解连接子的ADC药物的作用机制
单克隆抗体
曲妥珠单抗是一种IgG1κ轻链重组人源化mAB,靶向HER2的细胞外结构域IV。曲妥珠单抗与HER2结合后,会干扰PI3K下游通路并增强抗体依赖性细胞毒性 (ADCC),导致细胞死亡(图1A)。
酪氨酸激酶抑制剂
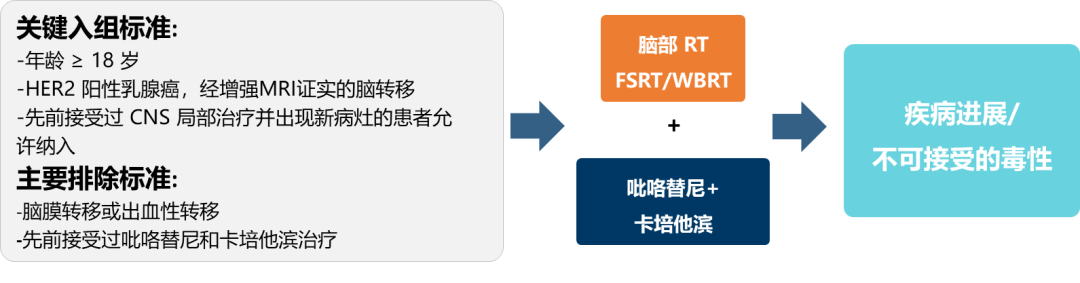
目前有三种TKI获得美国FDA批准用于治疗HER2阳性乳腺癌:Apatinib/ target=_blank class=infotextkey>LApatinib/ target=_blank class=infotextkey>拉帕替尼、奈拉替尼和图卡替尼。这些TKI可抑制HER2和EGFR家族的其他受体;抑制HER2时,可阻止酪氨酸激酶残基磷酸化,从而阻断下游信号传导(图1C)。鉴于其血脑屏障外显率增加,TKI是预防和治疗脑转移的一种特别重要的选择,脑转移是HER2+乳腺癌中未满足的主要需求。
ADC药物
ADC改变了HER2阳性乳腺癌的治疗模式。ADC药物由mAB、连接子和细胞毒性药物组成。T-DM1是第一个获批用于治疗乳腺癌的HER2靶向ADC,也是有史以来第一个获批用于治疗实体瘤的ADC。它由HER2靶向单克隆抗体、不可裂解的连接子、细胞毒性有效载荷微管蛋白抑制剂DM1组成。
基于DESTINY-Breast01研究,T-DXd于2019年12月获批用于HER2阳性转移性乳腺癌的后线治疗适应症,并且根据DESTINY-Breast03研究的结果,T-DXd于2022年3月获批晚期二线治疗适应症。此外,该药物于2022年8月获得美国FDA批准,用于治疗HER2低表达转移性乳腺癌(定义为IHC 1/2+且ISH未扩增)。目前,NCCN指南推荐T-DXd作为既往接受过治疗的HER2低表达乳腺癌患者的治疗选择。该T-DXd的一些关键特征包括抗HER2 mAB和有效负荷通过可裂解的连接子偶联;药物-抗体比达到8;细胞毒性有效载荷(DXd,一种高效拓扑异构酶I抑制剂)具有膜渗透性;一旦在HER2阳性细胞中释放,该分子可从细胞中扩散出来,并可对周围HER2肿瘤细胞和肿瘤微环境(TME)产生细胞毒性作用,该特征被定义为“旁观者效应”(图1D)。
抗HER2靶向治疗的耐药机制
抗HER2靶向药物的几种耐药机制已经明确。本节内容会讨论这些机制和克服它们的潜在策略。

图2.抗HER2靶向药物的耐药机制。图例:(A) 单克隆抗体结合位点的结构修饰;(B)HER2/ERBB2基因的激活突变;(C)HER2和雌激素受体之间的串扰;(D)EGFR和HER3的表达增加。(E)HER2表达水平可影响对某些抗HER2靶向治疗的反应;该图显示HER2低表达肿瘤通常对单克隆抗体无反应,但对ADC药物有反应。(F) 药物外排泵的活性和表达增加以及溶酶体转运改变是ADC耐药的独特机制
与HER2结合受损
抗HER2靶向治疗(尤其是mAB)的耐药机制之一是通过不同机制(如单克隆抗体结合位点的结构修饰)损害与HER2胞外域的结合(图2A)。p95HER2受体是全长p185HER2受体的截短形式,缺乏曲妥珠单抗结合位点,但保留激酶活性;这是HER2的一种高度致癌形式,因为其可自发形成同源二聚体,导致细胞增殖(图2A)。p95HER2受体存在于约30%的HER2阳性乳腺癌中,是预后不良的标志物,会导致淋巴结转移的风险增加。临床前模型显示,表达p95HER2的细胞对曲妥珠单抗单药治疗耐药,但可对TKI(如Lapatinib/ target=_blank class=infotextkey>拉帕替尼)产生应答。当用曲妥珠单抗和紫杉类联合治疗表达p95HER2的肿瘤时,细胞似乎对曲妥珠单抗治疗敏感,而曲妥珠单抗与蒽环类药物联合治疗的疗效似乎较差,目前原因仍不清楚。评估是否存在pp95HER2受体具有挑战性;已对几种检测方法进行了研究,包括免疫荧光和定量方法,如蛋白质印迹和流式细胞术。这些检测方法需要在临床试验中进行检测,以确定p95HER2检测是否在指导治疗决策中发挥作用。
粘蛋白-4是一种表面糖蛋白,可保护上皮结构并影响癌细胞的粘附、增殖和转移潜能。粘蛋白-4可稳定HER2,增强下游通路活化;还可阻断mAB的结合位点,导致对这些治疗耐药。已证明曲妥珠单抗耐药癌细胞中粘蛋白-4的沉默可增加曲妥珠单抗结合和ADCC效应。考虑到Mucin-4和HER2的相互作用发生在细胞外间隙,与上述p95HER2受体相似,TKI有可能克服这种耐药机制,拉帕替尼在HER2阳性胃癌的临床前模型中证实了这一点。透明质酸是另一种聚合物,可以阻断对该疗法耐药的曲妥珠单抗结合位点修复细胞。这可以通过阻断透明质酸的生成来克服,如体内和体外模型所示;另一种选择是再次使用TKI来克服这种耐药机制。
HER2突变
HER2/ERBB2基因的激活突变是抗HER2靶向治疗耐药的另一种机制;在约2-3%的所有乳腺癌中发现这些突变,并且与预后较差相关(图2B)。标准HER2检测方式(IHC和ISH)不能用于检测HER2突变,需要基因测序来识别。特定突变与抗HER2靶向治疗的不同预后和缓解率相关。L755S是最常见的突变,是拉帕替尼的获得性耐药机制,对图卡替尼有明显的交叉耐药,而对奈拉替尼似乎有治疗应答。随着新一代测序在转移性乳腺癌患者中的应用越来越多,今后很可能检测到更多突变。HER2突变需要被表征,且需要更多的信息来确定治疗HER2突变患者的最佳策略。T-DM1和T-DXd在HER2突变肺癌中显示出活性,正在进行的DPT01篮子研究 (NCT04639219) 正在评估T-DXd在HER2激活突变的实体瘤患者(包括晚期乳腺癌患者)中的活性。
HER2和雌激素受体之间的交互串扰
约50%的HER2阳性乳腺癌表达雌激素受体 (ER)。HER2和ER是乳腺癌中肿瘤增殖相关的关键驱动因素,临床前模型表明这些乳腺癌受体之间存在相关性。目前已经证实,在HER2阳性乳腺癌中,抗HER2靶向治疗会导致ER表达增加,从而使得肿瘤细胞存活(图2C)。基于此,靶向HER2和ER的联合治疗策略已展现出疗效。但是尚不清楚接受过抗HER2靶向治疗的患者是否可以从继续内分泌治疗以及后续治疗(化疗或基于ADC的治疗)中获益。
增加HER2和其他受体的信号转导
HER2表达增加可视为抗HER2靶向药物耐药的另一种机制;同样,受体抑制不完全可导致曲妥珠单抗治疗耐药。克服这些问题的潜在策略是进行抗HER2靶向治疗,均匀和/或永久阻断受体。此外,其他受体可在HER2阳性肿瘤中过表达,导致对靶向EGFR、HER3和VEGF 在内的抗肿瘤治疗耐药。
另一种耐药机制是通过形成EGFR和HER3同源二聚体绕过HER2阻断(图2D),并且这些蛋白的表达随曲妥珠单抗暴露而增加。体外研究表明,EGFR阻断可增加对抗HER2靶向药物的敏感性;然而,EGFR抑制剂吉非替尼和西妥昔单抗在乳腺癌中进行的临床试验并未观察到患者长期结局的改善。但值得注意的是,奈拉替尼和拉帕替尼作为EGFR和HER2 的抑制剂(奈拉替尼还可阻断HER4),已被证明可改善乳腺癌患者的预后。正在研究几种HER3阻滞剂作为单药治疗或与抗HER2靶向治疗联合治疗的策略。
另一种耐药机制是通过多种酪氨酸激酶的异常激活引起转录失调。临床前模型显示,抑制细胞周期蛋白依赖性激酶7或8可恢复对HER2靶向药物的敏感性。需要进行临床研究来确定这些药物联合抗HER2靶向药物的疗效和耐受性。
下游途径激活
PIK3CA编码磷脂酰肌醇3-激酶 (PI3K) 的p110α亚基。当HER2酪氨酸激酶被激活时,刺激PI3K,会导致蛋白激酶 B(AKT) 和哺乳动物雷帕霉素靶蛋白 (mTOR) 被激活,从而造成细胞增殖、生长和存活。在20%的HER2阳性乳腺癌中存在PIK3CA激活突变,这也是抗HER2靶向治疗耐药的机制之一。PIK3CA突变患者接受抗HER2靶向联合化疗作为新辅助治疗的病理学完全缓解率较低,并且接受这些疗法治疗转移性乳腺癌的PFS较差。CLEOPATRA研究的生物标志物分析显示,PIK3CA野生型患者的PFS长于PIK3CA突变患者(曲妥珠单抗+紫杉烷组为13.8 vs. 8.6个月,曲妥珠单抗+帕妥珠单抗+紫杉烷组为21.8 vs. 12.5个月),结果表明PIK3CA突变是预后不良的标志物。值得注意的是,EMILIA研究的生物标志物分析显示,携带或不携带PIK3CA突变的患者接受T-DM1治疗的效果相似,但携带 PIK3CA突变的患者接受拉帕替尼和卡培他滨治疗的效果更差,这些研究表明更有效的治疗可能克服PIK3CA突变导致的耐药机制。
另一种克服HER2耐药的潜在策略是通过在PI3K、AKT或mTOR水平阻断PI3K通路。多种抗HER2靶向药物都能够通过抑制该通路发挥抗肿瘤作用。在BOLERO 1和BOLERO 3试验中评估了mTOR抑制剂依维莫司的作用。在BOLERO 3试验中,观察到依维莫司带来了PFS的适度改善,但有显著毒性。在NeoPHOEBE试验中评估了曲妥珠单抗、紫杉醇和PI3K抑制剂 buparlisib的新辅助治疗效果,但该研究由于显著毒性而中止。PI3K抑制剂也正在HER2阳性乳腺癌中进行探索,例如EPIK-B2(NCT04208178) 是一项评估PI3Kα抑制剂alpelisib联合曲妥珠单抗和帕妥珠单抗作为HER2阳性、PIK3CA突变晚期乳腺癌患者维持治疗方案的III期研究。此外,PIK3特异性突变抑制剂如LOXO-783(靶向PI3K-αH1047R,约15%的乳腺癌中存在PI3K-αH1047R突变)的研究正在积极开展中。
PTEN是一种重要的肿瘤抑制基因,能够抑制PI3K通路并在DNA修复中发挥重要作用。据报告,5-10%的乳腺癌病例因突变导致PTEN缺失,而40-50%的病例出现杂合性缺失。PTEN突变率因乳腺癌亚型而异,HER2阳性亚型中约为5%,HR阳性中约为11%,三阴性中高达35%。在大多数情况下,PTEN和PIK3CA改变是相互排斥的;但是也有研究报道伴随突变。HER2阳性乳腺癌患者中PTEN缺失的临床意义仍不清楚。BCIRG 005和006试验的分析评估了早期HER2阳性乳腺癌患者(伴或不伴PTEN缺失)接受化疗和曲妥珠单抗治疗的结局,结果显示,PTEN缺失的患者仍能从曲妥珠单抗治疗中获益,但PFS和OS的总体结局更差。在APHINITY试验分析中报告了相似的结果。总体而言,这些数据表明PTEN是一种预后生物标志物,但不是一种预测性生物标志物。相反,PI3K通路激活的肿瘤PTEN水平低,对含依维莫司的治疗方案应答更好。PTEN突变可促进乳腺癌中MAPK通路依赖性,PI3K和MEK抑制剂的联合用药已被证明可改善对HER2阳性胃癌的治疗反应,未来的研究需要确定这种联合用药是否可以改善HER2阳性乳腺癌患者的结局。
还在HER2阳性乳腺癌中探索了JAK/STAT3通路,结果表明该通路激活的患者预后优于通路未激活的患者。一项研究发现,STAT相关基因标记可预测HER2阳性原发性乳腺癌患者的曲妥珠单抗治疗耐药性,这表明联合靶向STAT通路的药物可改善对曲妥珠单抗的治疗应答。然而,在一项1/2期临床试验中研究了JAK2抑制剂芦可替尼与曲妥珠单抗联合治疗既往接受过治疗的转移性疾病患者,与历史对照相比,结果显示预后无改善。需要开展进一步研究以确定其他抗JAK/STAT靶向药物是否发挥作用以及最佳治疗策略。
未能触发ADCC
ADCC效应最初被描述为曲妥珠单抗在动物模型中的作用机制,然后在一项小型临床研究中得到证实,该研究显示接受曲妥珠单抗新辅助治疗的所有患者均出现强烈的淋巴细胞浸润,尤其是达到pCR的患者。多种因素可影响抗HER2靶向治疗触发ADCC的能力,例如包括Fc γ受体多态性和肿瘤浸润淋巴细胞 (TIL) 的数量。已经研究了几种增强抗HER2靶向治疗相关ADCC效应的策略。
免疫细胞上表达的3种Fcγ受体可调节ADCC效应,包括CD16A、CD32A和CD32B。对 Margetuximab进行改造,以保留曲妥珠单抗的表位特异性;对5个氨基酸进行修饰,以增加对活化Fcγ受体CD16A的亲和力,并降低对抑制性Fcγ受体CD32B的活性,从而增强ADCC效应。SOPHIA是一项头对头、随机、开放标签的Ⅲ期临床研究,旨在评估margetuximab联合化疗对比曲妥珠单抗联合化疗用于既往经过抗HER2治疗的HER2阳性转移性乳腺癌患者的疗效和安全性(图1B)。
ADCC效应在曲妥珠单抗的作用机制中起着关键作用,免疫逃逸有可能是抗HER2靶向治疗耐药的机制。迄今为止,调整曲妥珠单抗Fc γ受体或在标准治疗的基础上加用ICI等策略已显示出患者预后的适度改善。
HER2异质性和HER2表达水平
HER2表达的肿瘤内异质性会影响抗HER2靶向治疗的反应,并被视为另一种耐药机制。在最近的一项研究中,HER2异质性被描述为肿瘤细胞中ERBB2扩增>5%但<50%的区域,或FISH检测为HER2阴性的区域。本研究评估了164例接受新辅助T-DM1和帕妥珠单抗治疗的HER2阳性肿瘤。在10%的病例中发现异质性。值得注意的是,无HER2异质性患者的pCR率为55%,而异质性肿瘤患者为0%。这些发现强调了HER2异质性在临床结局中的关键作用,未来的研究需要确定如何根据HER2表达优化治疗选择。
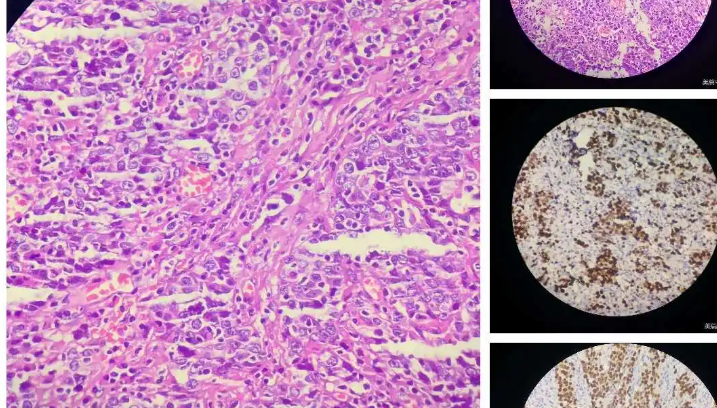
HER2表达水平也会影响对抗HER2靶向药物的反应。根据现行指南,HER2阳性定义为IHC 3+或2+且ISH检测扩增。约50%的乳腺癌为HER2部分表达,但是不符合HER2阳性的标准,而被定义为“HER2低表达”。既往几项研究探索了抗HER2靶向药物治疗HER2低表达乳腺癌。III期、随机NSABP B47试验评估了辅助化疗联合或不联合曲妥珠单抗在早期 HER2低表达乳腺癌患者中的作用。共有3270例患者接受随机分组,其中565例 (17.3%)为HR阴性,观察到联合曲妥珠单抗未改善HER2低表达乳腺癌患者的结局。基于这些发现和之前的数据,抗HER2靶向mAB不适用于HER2低表达乳腺癌的治疗。
新型ADC药物T-DXd(一种具有旁观者效应、更强效的抗HER2靶向治疗)被研究用于 HER2 低表达晚期乳腺癌的治疗。II 期DAISY试验中,179例既往接受过大量治疗的晚期乳腺癌患者接受T-DXd治疗;研究包括68例HER2 3+的乳腺癌患者、73例HER2低表达乳腺癌患者和38例HER2阴性乳腺癌 (IHC 0) 患者。在中位随访15个月时,HER2阳性队列患者的缓解率为70%,中位缓解持续时间为9.7个月,中位PFS为11.1个月。在HER2低表达队列中,缓解率为37.5%,中位缓解持续时间为7.6个月,中位PFS为6.7个月(HR阳性为6.9个月,HR阴性为3.5个月)。值得注意的是,在HER2 0队列中也报告了缓解,缓解率为29.7%,缓解持续时间为6.8个月,中位PFS为4.2个月(HR阳性为4.5个月,HR阴性为2.1个月)。DESTINY-Breast04是一项III期试验,在557例既往接受过治疗的转移性HER2低表达乳腺癌患者 (494例HR阳性,63例HR阴性) 中评估了T-DXd相比医生选择的化疗的疗效和安全性。在HR阳性队列中,中位PFS为10.1 vs.5.4个月(HR=0.51,p≤0.001),OS为23.9 vs.17.5个月(HR=0.64,p=0.003)。在ITT人群中,中位PFS为9.9个月vs. 5.1个月(HR=0.50,p≤0.001),OS为23.4个月vs. 16.8个月(HR=0.64,p=0.001)。DESTINY-Breast04研究成果改变了晚期乳腺癌的治疗模式,T-DXd已经成为目前大量晚期乳腺癌患者的新选择(图2E)。然而,仍然存在几个问题。DESTINY-Breast04纳入了少数HR-/HER2低表达乳腺癌患者,需要额外的数据来证实本研究的结果。IHC是一种定性检测方式,正在研究定量检测HER2的方式,以确定其是否能在改善该生物标志物的预后和预测结果方面产生更可靠和可重现的结果。目前正在探索的一些定量方法包括双抗体、HERmark和基于人工智能的成像。可能在不久的将来,将纳入定量HER2分析来指导临床决策。综上所述,使用强效抗HER2靶向药物可能克服与异质性相关的抗HER2靶向药物耐药性。
ADC耐药的独特机制
ADC重塑了乳腺癌的治疗格局,然而,患者最终也会对这些药物产生耐药性。上述机制可部分解释HER2阳性乳腺癌对ADC药物的耐药性,因为ADC由mAB组成,需要与HER2的胞外域结合才能发挥作用,同时,ADC药物也具有一些独特的耐药机制(图2F)。
药物外排泵的活性和表达增加是众所周知的化疗耐药机制,这也是T-DM1耐药的获得性机制,抑制药物外排泵可以恢复T-DM1的治疗敏感性。具有不可裂解连接子的ADC药物需要溶酶体中的蛋白酶降解抗体从而释放细胞毒性载荷,然后还需要通过溶酶体将其转移到其细胞内靶点。溶酶体转运的变化被报道为对具有不可裂解连接子(如T-DM1)的ADC获得性耐药的机制。可以通过使用具有相似mAB和可裂解连接子的ADC药物来克服。
已在接受 Sacituzumab Govitecan(SG) 治疗的TNBC患者中研究了ADC的耐药机制,发现其与靶点或有效载荷相关。ADC药物所需的靶抗原表达水平尚不清楚;如上所述,HER2低表达患者能从T-DXd中获益。同样,已证明TROP-2低表达的TNBC患者可从SG中获益。TOP1移码突变和TACSTD2/TROP-2突变[后者导致抗体(如SG)与细胞表面抗原结合减少]已被描述为对SG获得性耐药的机制。具有强效旁观者效应的ADC药物,其载药即使在靶抗原表达较低的情况下也可能发挥抗肿瘤作用。还应考虑肿瘤类型和患者肿瘤基于既往治疗的载药敏感性,因为这些可能在耐药性中发挥作用。
正在开发新型ADC,包括双特异性ADC、含免疫刺激载药的ADC和放射性核素ADC。还在研究联合治疗以增加ADCC效应、评估靶点表达以及改善ADC药物的内化作用。例如联合使用ADC和ICI以增强抗肿瘤活性和ADCC效应,例如上述提到的KATE2和 KATE3/MP42319(NCT04740918) 试验中评估了T-DM1和ICI的联合治疗策略。另外,一项I期、单臂研究 (NCT03523572)评估了在52例既往接受过治疗的HER2阳性和HER2低表达乳腺癌患者中联合使用T-DXd和纳武利尤单抗的疗效和安全性,本研究显示的抗肿瘤活性与 T-DXd的既往研究一致;然而,尚不清楚ICI是否可以改善治疗结局,还需要开展随机研究来回答该问题。此外,ICI在既往接受过治疗的乳腺癌患者中的疗效有限,尚不清楚该联合治疗是否在一线治疗之外发挥作用。
在靶抗原表达方面,一项临床前研究表明,暴露于T-DM1后,肿瘤细胞中HER2表达水平会降低。使用具有旁观者效应的更强效ADC可能克服这种耐药机制;然而,关于ADC使用次序和交叉耐药的数据很少。
ADC药物需要通过内吞作用进入靶细胞后才能发挥抗肿瘤效应。包括T-DM1在内的各种ADC通过网格蛋白介导的内吞作用进入细胞。临床前模型显示,当T-DM1通过小窝蛋白介导的内吞作用进入细胞时,由于ADC内化到小窝蛋白-1囊泡中,溶酶体活性降低,从而导致药物的疗效降低。但这只在T-DM1中报道过,使用具有可裂解连接子的ADC可能克服这种耐药机制。
结论
尽管抗HER2靶向治疗改变了HER2阳性乳腺癌和HER2低表达乳腺癌患者的治疗格局,但是仍存在新发或获得性耐药的挑战。目前已经探索了针对抗HER2靶向治疗耐药的多种潜在机制,深入了解耐药机制并开发出克服耐药的潜在策略对于进一步提升乳腺癌患者的生存获益至关重要。
专家介绍
赵艳霞 教授
华中科技大学同济医学院附属协和医院
医学博士、主任医师、副教授、硕士生导师
乳腺肿瘤内科支部书记/副主任、病区主任
武汉市区人大代表
美国哈佛大学麻省总医院放射肿瘤科博士后
中国临床肿瘤学会乳腺癌专家委员会委员
中国抗癌协会乳腺癌专业委员会青年专家
中国医师协会肿瘤分会乳腺专委会委员
中国健康促进基金会乳腺癌专委会常务委员
中国抗癌协会肿瘤异质性和个体化治疗专委会委员
湖北省抗癌协会乳腺癌专业青年委员会副主任委员
湖北省临床肿瘤学会青年专家委员会副主任委员
湖北省抗癌协会康复与姑息专家委员会常务委员
湖北省抗癌协会乳腺癌专业委员会委员
Schlam I, Tarantino P, Tolaney SM. Overcoming Resistance to HER2-Directed Therapies in Breast Cancer. Cancers (Basel). 2022 Aug 18;14(16):3996.